ポートラーザが製造販売承認取得
2019年6月18日、ポートラーザという薬剤が製造販売承認を取得しました。
がん治療に携わる、治療と並行した緩和ケア医である私がお伝えします。
どのような薬剤なのか、3分でわかるように解説します。
ポートラーザは分子標的薬 肺扁平上皮がんが対象
ポートラーザは分子標的薬という薬剤に属します。
普通の抗がん剤とは異なります。
分子標的薬とは、非常に簡単に言うと、がんを引き起こす遺伝子異常等に作用する薬剤であり、いわゆる「ピンポイント」で効く薬です。
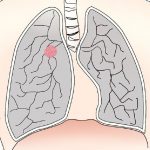
今回ポートラーザは、肺がんの中の、扁平上皮がんというがんに対して認可されました。
肺がんは大きく分けて、①非小細胞肺がん、②小細胞肺がんにわかれます。
①の中に、A)扁平上皮がん、B)非扁平上皮がん<腺がん、大細胞がん>が属します。
B)非扁平上皮がんに関しては、チロシンキナーゼ阻害剤等と呼ばれる分子標的薬での治療がかなり充実してきました。
一方で、A)扁平上皮がんに関しては、チロシンキナーゼ阻害剤の効果は限定的でした。
分子標的薬の恩恵が相対的にあまり得られない状況にあった中、今回は肺の扁平上皮がんに対して効果を期待できる分子標的薬としてポートラーザが出て来たのです。
ポートラーザの効果のほどは?
今回の承認では下記が使用法となります。
「ゲムシタビン及びシスプラチンとの併用において、通常、成人にはネシツムマブ(遺伝子組換え)として1回800mgをおよそ60分かけて点滴静注し、週1回投与を2週連続し、3週目は休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する」
読んで頂ければわかるように、一般的な抗がん剤であるゲムシタビン(商品名ジェムザール)とシスプラチンとの併用で使用されます。
承認される際には、必ずその背景となる試験があります。
「ゲムシタビン+シスプラチン」に「ポートラーザ」を追加した群で、生存期間中央値が11.5ヶ月(対照群では9.9ヶ月)と統計的に意味のある程度で延長したという結果です。
上記の試験結果を元に、アメリカでは2015年に転移がある肺扁平上皮がんの一次治療(最初の治療)として承認されています。
なお、今回日本では、適用が「切除不能な進行・再発の扁平上皮非小細胞肺癌」となっており、特にEGFR陽性・非陽性を問わずに投与できるような印象があります。
ただ下記の試験を照覧すると、やはりEGFR陽性例で生存期間への好影響が認められ、EGFR陰性例ではその恩恵はないようです。
副作用として、グレード3以上という重い程度の副作用が、低マグネシウム血症(10%。対照群では1%未満)、皮疹(6%。対照群では1%未満)で出現したと報告されています。
ポートラーザの副作用は?
国内の試験(JFCM試験)によると、皮膚障害[95.6%:ざ瘡様皮膚炎(78.9%)、皮膚乾燥(52.2%)、爪囲炎(48.9%)、そう痒(7.8%)、手掌・足底発赤知覚不全症候群(6.7%)、皮膚亀裂(5.6%)]、口内炎(31.1%)、体重減少(5.6%)、発熱(4.4%)、嘔吐(2.2%)等であったとのことです。
皮膚系の副作用が多いですね。
分子標的薬の副作用対策は、支持療法あるいは緩和ケアの範疇に含まれます。
しっかりと対処を医療者に希望することが大切です。
ポートラーザのまとめ
薬剤が続々投入されてきた腺がん等の「非小細胞肺がんの非扁平上皮がん」に比べて、扁平上皮がんや小細胞肺がんは薬剤が相対的に少ない印象があります。
今回、切除不能な進行・再発肺扁平上皮がんの一次治療(最初の治療)としてポートラーザが認可されたことは、もちろん扁平上皮がんの方にとっては良いことでしょう。
治療の円滑な継続には、十分な副作用対策が重要です。
支持療法の専門家である病院の緩和ケア部門や早期からの緩和ケア外来等に相談し、苦痛少なく治療が継続できるようにすることが、良い薬効を得るための秘訣と言えるでしょう。



治療薬の解説.jpg)